Il Reg. (UE) n. 2019/6 (Regolamento VMP) sarà applicabile dal 28 gennaio 2022 e apporterà diverse modifiche all’uso degli antimicrobici in medicina veterinaria. Quindi, ciò riguarda anche il mondo del latte.
Abbiamo visto quale sarà l’impatto sulla profilassi in un recente articolo (leggi “Asciutta a tappeto, taglio netto alla profilassi da gennaio 2022. L’alternativa? L’asciutta selettiva”).
Tra le misure chiave, il regolamento VMP getta le basi per le restrizioni sui prodotti utilizzati sia nei medicinali per uso umano che veterinario. L’obiettivo è preservare l’efficacia degli antibiotici che sono di importanza critica per il trattamento delle infezioni nell’uomo. Sono necessarie restrizioni su questi prodotti poiché i batteri resistenti agli antimicrobici possono derivare dall’uso di antimicrobici negli animali da reddito ed arrivare all’uomo attraverso la catena alimentare.
L’articolo 37 del regolamento VMP stabilisce i motivi del rifiuto dell’autorizzazione all’immissione in commercio per i medicinali veterinari (VMP). In particolare, nei paragrafi da 3 a 6 sono definiti i criteri per respingere l’autorizzazione di antimicrobici quando sono riservati al trattamento di determinate infezioni nell’uomo. Inoltre, la Commissione europea dovrà adottare atti delegati per integrare il regolamento VMP “attraverso la definizione di criteri per la designazione degli antimicrobici riservati al trattamento di determinate infezioni nell’uomo, in modo da preservare l’efficacia di tali antimicrobici“. Per fare questo, prenderà in considerazione i pareri scientifici delle pertinenti agenzie dell’Unione, in particolare EMA, EFSA e altri.
Facciamo un piccolo passo indietro e definiamo l’attuale quadro relativo agli antibiotici di importanza critica (CIA, critically important antibiotics) per gli esseri umani. Si tratta degli antimicrobici più importanti per il trattamento delle infezioni nell’uomo. Secondo la classificazione dell’Organizzazione Mondiale della Sanità (OMS), i CIA possono essere di massima priorità (Categoria 1, Highest Priority – il loro uso nella profilassi in veterinaria dovrebbe essere evitato) e di priorità alta (Categoria 2, High Priority – antibiotici che rappresentano una minaccia per la salute umana se usati negli animali).
Nel 2019, l’OMS ha aggiornato l’elenco della lista dei CIA. Con questa, l’OMS ha sviluppato e implementato i criteri per classificare i prodotti antimicrobici sulla base della loro importanza nella salute umana.
Lo scopo della lista è quello di aiutare a preservare l’efficacia degli antimicrobici oggi disponibili per l’uomo promuovendone l’uso prudente sia nella medicina umana che in quella veterinaria. Essa comprende anche i CIA della Categoria 1, ovvero: chinoloni, cefalosporine di terza generazione ed oltre, macrolidi e chetolidi, glicopeptidi e polimixine.
Essendo OZOLEA in prima linea nella lotta contro l’antimicrobico resistenza nelle vacche da latte, in particolare studiando e sviluppando strumenti per supportare la funzionalità del tessuto endo-mammario, vale la pena menzionare il motivo per cui i chinoloni e le cefalosporine, utilizzati nei bovini da latte per il trattamento clinico e le mastiti subcliniche causate da E. coli, sono incluse in questa categoria.
I chinoloni sono una delle poche sostanze disponibili per il trattamento delle infezioni gravi da Salmonella ed E. coli nell’uomo. Inoltre, sono noti per la loro capacità di selezionare Salmonella ed E. coli resistenti ai chinoloni negli animali. Stesso problema per le cefalosporine di terza generazione e di generazione superiore: sono una delle poche terapie disponibili per le infezioni gravi da Salmonella ed E. coli nella medicina umana, in particolare nei bambini e sono note per la selezione di Salmonella ed E. coli resistenti alle cefalosporine negli animali. L’incidenza delle infezioni nell’uomo dovute a Salmonella ed E. coli è sostanzialmente alta: queste sostanze sono quindi necessarie come ultima risorsa per il trattamento in medicina umana.
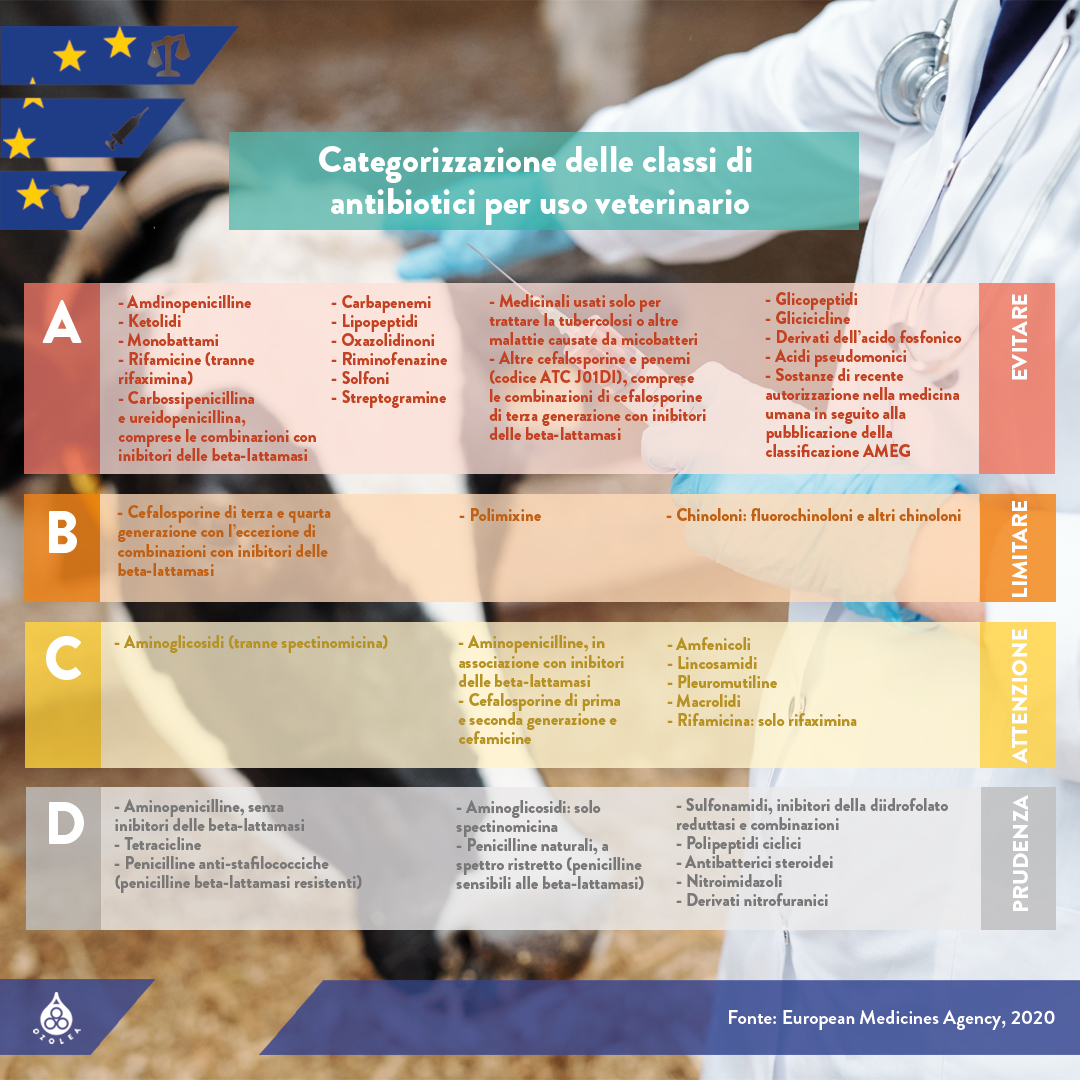
Nell’UE, lo scorso anno l’European Medicines Agency (EMA) ha aggiornato il proprio parere scientifico, preparato dall’AMEG (Antimicrobial Advice Ad Hoc Expert Group) sulla categorizzazione degli antibiotici. L’EMA incoraggia i veterinari a controllare e considerare questo documento quando prescrivono antibiotici per gli animali. Il documento non sostituisce le linee guida generali, ed altri aspetti (Riassunto delle caratteristiche del prodotto, limitazioni all’uso nelle specie da reddito, peculiarità regionali di infezione ed AMR, politiche nazionali, etc.) dovrebbero essere considerati.
Questo documento è in linea con l’approccio One-Health (leggi l’articolo di OZOLEA “L’approccio One Health contro l’antimicrobico resistenza“). La nuova classificazione introdotta dall’AMEG comprende attualmente quattro categorie:
A) “Evitare”: include antibiotici attualmente non autorizzati in medicina veterinaria nell’UE. Non possono essere utilizzati in animali da produzione alimentare e possono essere utilizzati in singoli animali da compagnia solo in via eccezionale;
B) “Limitare“: questa categoria classifica gli antibiotici di importanza critica (chinoloni, cefalosporine di 3a e 4a generazione, polimixine) nella medicina umana e il loro uso negli animali dovrebbe essere limitato per mitigare qualsiasi rischio correlato alla salute pubblica;
C) “Attenzione”: questa categoria si riferisce a quegli antibiotici le cui alternative in medicina umana sono generalmente disponibili nell’UE, ma esistono solo poche alternative in specifiche indicazioni veterinarie. Il loro uso dovrebbe essere fatto solo quando non ci sono antimicrobici clinicamente efficaci nella categoria D;
D) “Prudenza”: include antibiotici destinati ad essere utilizzati come trattamenti di prima linea, quando possibile. Questi prodotti possono essere utilizzati negli animali con prudenza: pertanto, gli utilizzatori finali dovrebbero evitare usi non necessari e lunghi periodi di trattamento, limitando il trattamento di gruppo a situazioni in cui la terapia individuale non è fattibile.
Nel documento dell’EMA, è stata considerata anche la via di somministrazione per valutare il suo impatto sulla selezione dell’AMR.