Recentemente (leggi “Cosa ci dicono le alterazioni visibili nel latte”), ci siamo concentrati sullo scenario peggiore in caso di problematiche alla mammella nelle vacche in lattazione per comprendere il meccanismo alla base del danno al tessuto e l’importanza di una corretta rimozione dei primi getti di latte.
Essere in grado di identificare e comprendere il significato dei coaguli nel latte e di altri segni visibili nei primi getti ci aiuta a rilevare precocemente i casi clinici di mastite. Un corretto approccio in un momento così delicato è strategico nella prevenzione e nel controllo delle mastiti nelle vacche da latte. E ha anche un impatto nel ridurre al minimo le ricadute di casi clinici nella nostra mandria da latte.
La ricorrenza della mastite clinica è qualcosa di frustrante per gli allevatori. Può causare enormi perdite economiche agli allevamenti da latte.
Le ragioni dietro al carattere recidivo delle mastiti viene spiegato in termini di infezione persistente della ghiandola mammaria da parte di un agente patogeno o reinfezione della mammella (o quarto) dopo un trattamento antibiotico.
Come per altre problematiche, vi è una serie di fattori predisponenti il rischio di mastite ricorrente: numero di parti (il rischio è maggiore nelle vacche più anziane), una maggiore produzione di latte, quali agenti patogeni sono stati coinvolti nei casi precedenti e se la terapia antibiotica è stata rigorosamente seguita in precedenza.
I casi clinici ricorrenti rappresentano una perdita economica dovuta all’impatto su vacche da latte, mandrie e allevamenti: riduzione della produzione di latte ed aumento del rischio di abbattimento e mortalità. Inoltre, dovremmo anche considerare i costi sostenuti per la salute animale con lo scopo di trattare le vacche colpite.
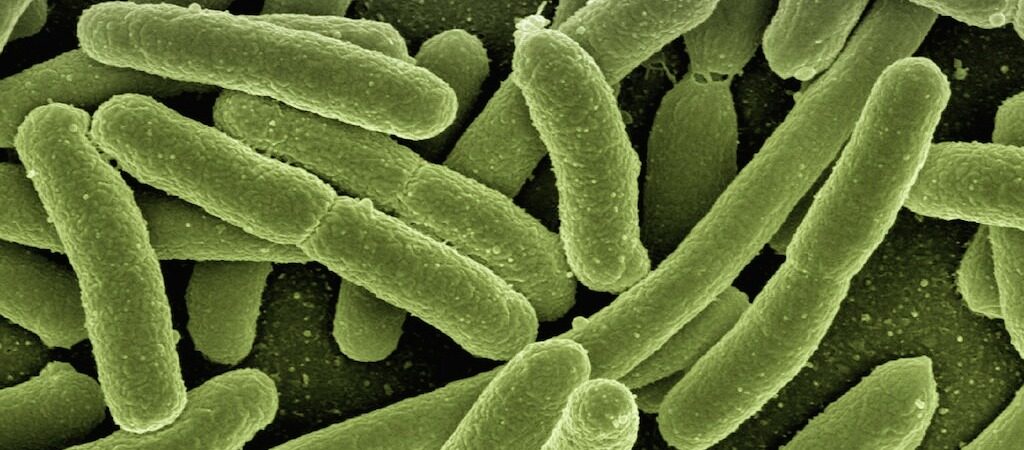
Indubbiamente, i batteri hanno molti vantaggi selettivi rispetto ad altri esseri viventi. Sono sopravvissuti alle peggiori condizioni ambientali, che hanno in qualche modo guidato la loro evoluzione. Sono semplici e si replicano a velocità elevate. E, tra le altre cose, possono formare biofilm.
La capacità di formare biofilm diventa un vero vantaggio per i patogeni che causano mastiti poiché essa facilita la persistenza dei batteri nella mammella. Sfortunatamente, questa non è l’unica conseguenza: è stato dimostrato che i biofilm hanno un ruolo nell’aumentata resistenza ad antimicrobici e al sistema difensivo dell’ospite.
I biofilm batterici sono più difficili da trattare ed eradicare, quindi sapere come i microrganismi interagiscono all’interno di queste strutture e come queste strutture si diffondono nella mammella potrebbe farci ragionare su differenti strategie di prevenzione e controllo.
La formazione della struttura del biofilm inizia con l’adesione a una superficie e la successiva formazione della struttura multicellulare. Le forze adesive sono richieste dal biofilm per colonizzare le superfici e comunicare. I biofilm hanno anche il potenziale per creare canali grazie a forze di perturbazione. I canali sono necessari per il trasporto di sostanze nutritive, ossigeno e metaboliti attraverso la struttura.
Queste forze perturbative sono essenziali anche per il distacco delle cellule, che limitano l’espansione della struttura del biofilm ma consentono all’infezione di diffondersi e colonizzare altre nicchie nella mammella della vacca attraverso un processo dinamico. Questo aspetto può rendere sistemica la diffusione dell’infezione.
Cambiamenti genetici e fisiologici significativi si verificano nei batteri che formano il biofilm. L’effetto che ne deriva è una perdita di sensibilità agli antibiotici.
La presenza di biofilm nelle ghiandole mammarie può essere collegata ad una riduzione dell’efficacia delle terapie antibiotiche. Secondo la letteratura scientifica (Gomes et al., 2016) la formazione di biofilm può essere innescata da concentrazioni sub-inibitorie di diversi agenti antimicrobici.
Inoltre, è stato studiato l’effetto dell’ambiente sulla formazione del biofilm (Atulya et al., 2014), in particolare l’influenza dei componenti del latte, riscontrando un certo effetto esercitato dal pH. Una diminuzione del pH facilita la formazione di biofilm causando così gravi problemi quando si utilizzano antibiotici a carattere acido per il trattamento la mastite.
La ricorrenza di infezioni endo-mammarie e il fatto che i biofilm sono meno suscettibili ai trattamenti antibiotici possono esacerbare l’attuale sfida dell’antimicrobico resistenza.
In questo contesto, la prevenzione, il controllo, l’uso responsabile degli antibiotici e un dialogo reciproco tra allevatori e veterinari sono misure chiave per affrontare le mastiti recidive.
Inoltre, c’è un altro aspetto da considerare: l’efficacia di uno specifico antibiotico dipende anche dalle sinergie che crea con il tessuto target nel corpo della vacca. Il tessuto mammario, se danneggiato, non sarebbe in grado di svolgere adeguatamente il suo ruolo in questa potente sinergia.
Pertanto, la protezione del tessuto all’interno della mammella è essenziale, come abbiamo già visto in precedenza.
Quegli strumenti giusti che proteggono il tessuto mammario, in combinazione con tutte le pratiche sopra menzionate, possono davvero aiutare a invertire l’andamento.